Télomères et télomérase : leur rôle dans le vieillissement du corps humain.
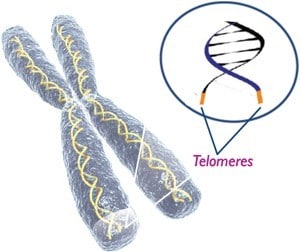 Nos gènes sont disposés le long des molécules d’ADN bitorsadées appelées chromosomes. À l’extrémité des chromosomes se trouvent des rallongements d’ADN appelés télomères. Ces télomères ont pour fonction la protection de nos données héréditaires et la division des cellules. Ils conservent par ailleurs des secrets sur le vieillissement, ou encore, la façon dont nous contractons certaines maladies comme les cancers (1,2). Les télomères empêchent les pointes des chromosomes de s’effilocher et de se coller les unes aux autres, ce qui détruirait ou brouillerait l’information génétique d’un organisme, provoquant ainsi une apoptose (mort de la cellule) au niveau des cellules somatiques ordinaires. Or, les cellules somatiques ordinaires ne sont pas en capacité de réparer de tels dommages.
Nos gènes sont disposés le long des molécules d’ADN bitorsadées appelées chromosomes. À l’extrémité des chromosomes se trouvent des rallongements d’ADN appelés télomères. Ces télomères ont pour fonction la protection de nos données héréditaires et la division des cellules. Ils conservent par ailleurs des secrets sur le vieillissement, ou encore, la façon dont nous contractons certaines maladies comme les cancers (1,2). Les télomères empêchent les pointes des chromosomes de s’effilocher et de se coller les unes aux autres, ce qui détruirait ou brouillerait l’information génétique d’un organisme, provoquant ainsi une apoptose (mort de la cellule) au niveau des cellules somatiques ordinaires. Or, les cellules somatiques ordinaires ne sont pas en capacité de réparer de tels dommages.
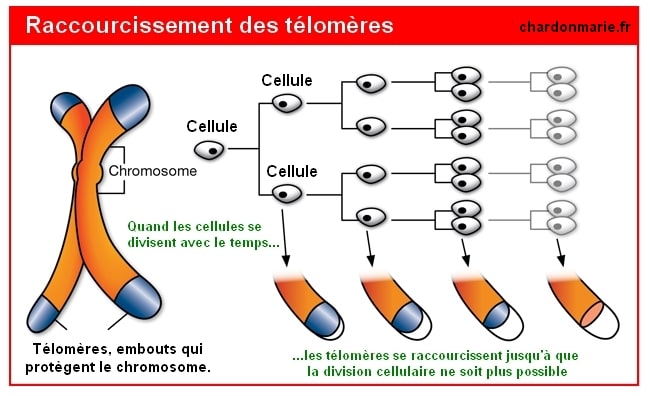
Pourtant, chaque fois qu’une cellule se divise, les télomères se raccourcissent. Quand ils sont trop petits, ils ne peuvent plus assurer leur rôle de protection. La cellule somatique qui ne peut plus se diviser va donc entrer en sénescence et stopper sa croissance. Ce qui entraine la détérioration des organes. Ce processus de raccourcissement est associé au vieillissement, au cancer et à un risque accru de décès. En outre, l’érosion des télomères est un marqueur de risque de maladies cardio-vasculaires chez les sujets masculins d’âge moyen.
Il existe une enzyme nommée télomérase, dont la mission est de conserver la longueur du chromosome en ajoutant des bases aux extrémités des télomères (3). À mesure que les cellules se fractionnent à plusieurs reprises, il n’y a pas assez de télomérase, donc les télomères se courbent et les cellules vieillissent.
L’activité cellulaire de la télomérase est augmentée dans les cellules cancéreuses, ce qui contribue à leur prolifération. En effet, la plupart des cancers génèrent de la télomérase à un stade tardif, l’évolution du cancer débutant par une dévastation importante des télomères.
Une étude danoise menée sur près de 65 000 sujets suivis pendant 7 ans a d’ailleurs démontré que des télomères courts sont une cause de mortalité certaine : les 10% de personnes ayant les télomères les plus courts affichaient en effet un taux de décès de 3,38 plus élevé que les 10% ayant les télomères les plus longs, et ce, indépendamment de l’âge. Toutes les autres variables de santé sont un facteur moindre par rapport à l’âge et la longueur des télomères.
La limite de Hayflick : un espoir pour dans la lutte contre le vieillissement.
Il y a presque 57 ans, Leonard Hayflick a découvert que les cellules humaines normales en culture avaient une capacité à se diviser limitée (la limite pour l’homme se situe aux environs de 52 et est liée au raccourcissement des télomères), après quoi elles deviennent sénescentes – un phénomène connu sous le nom de « limite Hayflick». La limite Hayflick correspond au nombre de fois maximal qu’une cellule peut se diviser, après quoi elle meurt. Les résultats de Hayflick ont été fortement contestés à l’époque, mais ses réalisations ont permis à d’autres de progresser considérablement vers la compréhension et la manipulation des mécanismes moléculaires du vieillissement(4).
Il arrive de temps à autre que certaines cellules, arrivées à leur fin de vie biologique, ne se répliquent plus mais ne meurent pas pour autant. Elles deviennent alors redoutablement inactives, sécrétant des matières toxiques et provoquant des maladies comme le diabète. Des résultats récents indiquent même que les cellules sénescentes pourraient, dans certains cas, encourager l’apparition de cellules tumorales ou induire la croissance de cellules prénéoplasiques. La sénescence agirait alors en véritable « cheval de Troie » biologique. (5)
L’intégrité des télomères est un régulateur essentiel du vieillissement humain et de la formation de cancers. En effet, si le raccourcissement des télomères pouvait être ralenti voire stoppé, il deviendrait alors possible d’augmenter l’espérance de vie.
Cette observation suggère que la recherche de substances ou protéines impliquées dans le maintien des télomères pourrait représenter des objectifs moléculaires de recherche et d’intervention thérapeutique dans le domaine du cancer et d’autres maladies liées au vieillissement.
Chardon-Marie et silymarine : une lueur d’espoir dans la lutte contre le cancer.
Des études récentes ont démontré que la silymarine, composant clé du chardon marie montrant de fabuleuses vertus hépatoprotectrices et antioxydantes, peut protéger les cellules progénitrices endothéliales de la sénescence. Les chercheurs ont en effet prouvé que la silymarine augmente jusqu’à 3 fois la télomérase de ces cellules (4), tout en réduisant leur sénescence, et augmente jusqu’à 64% leur activité en comparaison de cellules traitées avec d’autres substances actives comme la rapamycine.
Concernant le cancer de la prostate, il semble que les cellules qui en sont responsables sont liées à la production de dihydrotestosterone, qui dépend elle-même de la télomérase (5). Une étude a montré le potentiel de la silibinine, un composant de la silymarine et du chardon-Marie, comme anti-cancer et régulateur de la télomérase et de divers antigènes spécifiques de la prostate. Les sujets ont été traités avec divers taux de
silibinine, et ont tous montré une chute de la télomérase dans les cellules responsables de la cancérogenèse, ainsi qu’une réduction de la prolifération des cellules malades.
Enfin, la silymarine et ses flavonoïdes sont actuellement étudiés dans le traitement de la leucémie. L’apoptose des cellules K562 (6) à l’origine de cette maladie, et leur télomérase sont en effet réduites suite à la prise de silymarine, et sont en cours d’études. Les scientifiques s’appuient notamment sur le test de coloration Hoechst 33342 et la cytométrie en flux. L’activité de la télomérase est quant à elle déterminée en utilisant le protocole de l’amplification de la répétition télomérique.
L’extrait de chardon-Marie est donc très prometteur dans la lutte contre le cancer, avec entre autres une silymarine capable de limiter la prolifération de cellules jusqu’alors considérées comme immortelles.
Références:
(1) https://fr.wikipedia.org/wiki/Télomère#T.C3.A9lom.C3.A8res_et_t.C3.A9lom.C3.A9rases_en_m.C3.A9decine
(2) https://fr.wikipedia.org/wiki/Télomérase
(3) https://fr.wikipedia.org/wiki/Limite_de_Hayflick
(4) J Cardiovasc Pharmacol. 2010 Dec;56(6):610-8. doi: 10.1097/FJC.0b013e3181f78dc3. Silymarin inhibits endothelial progenitor cells’ senescence and protects against the antiproliferative activity of rapamycin: preliminary study.
(5) J Urol. 2004 May;171(5):1934-8. Inhibition of telomerase activity and secretion of prostate specific antigen by silibinin in prostate cancer cells.
(6) Planta Med. 2012 Jun;78(9):899-902. doi: 10.1055/s-0031-1298464. Epub 2012 Apr 24. The effect of silymarin on telomerase activity in the human leukemia cell line K562.

Super je cherchais ces explications à la suite de ma lecture du livre « la vie immortelle d’Henrietta Lacks » dont les cellules cancereuses sont immortelles,et ont servi à la science depuis 1951, je vous emprunte le schéma pour mon article.
c’est tres interessent cet article mais jusqu ‘a quel point on peut le suppose comme un tt merci
c’est trés important de savvoir q’une telle plante peut nous offrir tout ces bienfait mais est ce que une personne qui a RCH ( maladie auto-immune) peut il prendre cette plante merci